Solubilité du dioxyde de carbone dans l'océan
La dissolution du dioxyde de carbone provenant de l'atmosphère varie avec les conditions de surface des océans, en particulier avec la température (effet de solubilité) et l'alcalinité (capacité de l'eau à neutraliser un acide).
Effet de l'alcalinité
Dans l'océan, le dioxyde de carbone réagit suivant l'équation d'équilibre suivante :
\(CO_2 + H_2O\) ⇔ \(H_2CO_3\) ⇔\( H^+ + HCO_3^-\) ⇔\( 2H^+ + CO_3^{2-}\)
Ces molécules cohabitent en fonction du pH. Actuellement, le pH des océans se situe à 8,2 et le graphe suivant montre que l'espèce prédominante dans ces conditions est l'ion hydrogénocarbonate \(HCO_3^-\).
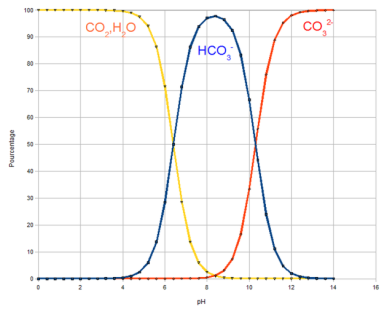
Si la concentration de \(CO_2\) atmosphérique augmente, cela va avoir pour conséquence d'augmenter la concentration des protons \(H^+\), de diminuer le pH et donc d'acidifier l'océan. De plus, si le pH diminue alors la concentration en ions hydrogénocarbonate va diminuer tandis que la concentration en \(CO_2\) va croître jusqu'à un certain seuil où le dégazage va se produire. Ce phénomène décrit l'extraction des gaz dissous dans un liquide. Cela aura donc pour effet de réémettre le \(CO_2\) dans l'atmosphère.
Les simulations fondées sur les scénarios du RSSE prévoient une réduction du pH de surface des océans comprise entre 0,14 et 0,35 en moyenne mondiale au cours du \(21^e\) siècle.
Effet de la température
Il est évident que la température des océans va augmenter au fil des années si l'émission de gaz à effet de serre ne diminuent pas. Cela engendrerait donc une diminution de la solubilité du \(CO_2\) dans l'eau (caractéristique générale de la solubilité des gaz dans les liquides) :
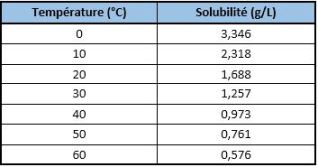
Par conséquent, l'océan, considéré comme le puit de carbone le plus important de la planète, pourrait voir sa capacité de stockage diminuée dans un futur proche.
Complément : Sources
Intergovernmental Panel on Climate Change, 2013. Chapter 06: Carbon and Other Biogeochemical Cycles, New York: Cambridge University Press. pp. 498,528-532,544-545.