I.1 Les niveaux d'énergie
Théorie des quanta (Max Planck) :
L'énergie ne peut pas être échangée de manière continue mais par multiples entiers d'une quantité minimale d'énergie : le quantum énergétique.
Modèle de Bohr (Niels Bohr) :
L'énergie d'un électron est quantifiée, c'est à dire qu'elle ne peut prendre que certaines valeurs déterminées appelées également "niveaux d'énergie".
La valeur nulle de l'énergie correspond à l'état ionisé (électron sorti du champ d'attraction du noyau). Donc les autres états de l'électron (couches) correspondent à des valeurs d'énergie négatives. En l'absence d'apport d'énergie extérieure, les électrons se trouvent sur les niveaux d'énergie les plus bas possibles. L'atome est alors au niveau fondamental. Sinon, il est dans un état excité.
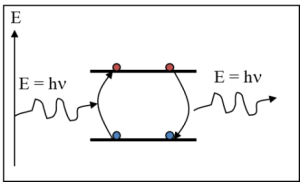
Influence d'un apport d'énergie sur un atome :
Les changements d'énergie d'un électron ne peuvent s'effectuer que par sauts discontinus d'un niveau à l'autre. Ce sont des transitions énergétiques. L'absorption d'énergie par un atome se traduit par le passage de certains électrons à des états énergétiques plus élevés normalement inoccupés. On dit alors que l'atome est excité. Lors du retour à l'équilibre, l'énergie libérée apparaît sous forme de rayonnement électromagnétique de longueur d'onde λ définie par :
avec h = constante de Planck = 6,62.10-34m2.kg.s-1