Niveaux d'énergie
Fondamental :
Chaque niveau d'énergie est caractérisé par les valeurs correspondantes de quatre nombres quantiques. À chaque niveau d'énergie correspond également une trajectoire circulaire stable d'un électron autour du noyau (l'électron ne rayonne pas et donc ne perd pas d'énergie) et une distance électron-noyau.
Dans l'expression littérale de ces énergies et de ces distances figure le paramètre n qui peut prendre les valeurs entières 1,2,3,... c'est le nombre quantique principal. Les distances électron-noyau sont proportionnelles à n2 et les énergies permises à –A/n2 (A = 2,179.10-18 J).
Les 4 nombres quantiques :
Les 4 nombres quantiques :
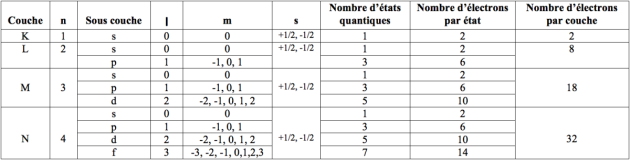
Le nombre quantique principal | n => 1, 2, 3, ; il définit la couche du tableau de Mendeleïev (K, L, M, N, ...), |
Le nombre quantique orbital (secondaire) | l => 0, 1, ..., n-1 ; il définit la sous couche (s, p, d, f, g, ...), |
Le nombre quantique magnétique | m => -l...0...+l , |
Le nombre quantique de spin | s => +1/2 ou –1/2. |
n et s sont des variables indépendantes alors que l et m ne peuvent prendre que certaines valeurs en fonction de n.
Définition : Principe d'exclusion de Pauli :
Dans un atome, il ne peut y avoir plus d'un électron décrit par un même ensemble de valeurs des 4 nombres quantiques.
On voit sur le tableau qu'il existe un nombre maximal d'électrons par couche = 2n2.
La configuration électronique d'un atome est la façon dont ses Z électrons sont distribués.
Exemple : Exemple du silicium
Le Silicium est le 14ème élément de la classification périodique: Z = 14.
Ses 14 électrons sont répartis comme suit (remplissage dans l'ordre):
1s2 2s2 2p6 3s2 3p2
La couche externe ou de valence est la 3ème (couche M). Elle est incomplète (sous-couche p). Elle possède 4 électrons (il reste 4 places libres dans la sous-couche p).
Fondamental :
Un atome est à son état fondamental si son énergie est minimale
Attention :
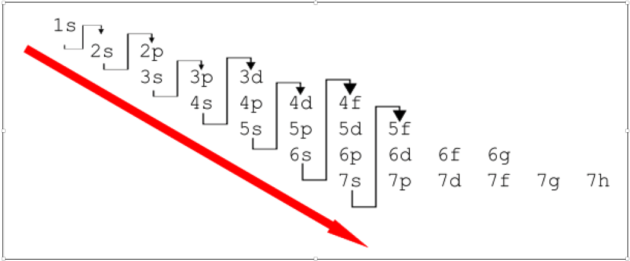
Pour les 18 premiers éléments de la classification périodique (Z = 1 à 18) cette condition est remplie lorsque les électrons remplissent les niveaux d'énergie les plus bas. Au delà de Z = 18, la configuration d'énergie électronique minimale peut comporter des inversions dans l'ordre de remplissage des sous-couches. Ceci est dû au fait que le critère de stabilité maximale est la valeur de l'énergie totale de l'atome qui n'est pas la somme des énergies individuelles des électrons, il y a aussi des termes prenant en compte les interactions entre électrons.
Exemple : Exemple du Germanium
Le Germanium (Z = 32):
En suivant la règle de Klechkowski, cela donne :
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
La couche de valence est la 4ème (couche N). Elle est incomplète (sous-couche p). Elle possède 4 électrons (il reste 4 places libres dans la sous-couche p).