Exemples de fonctions de distribution radiale
Nous présentons ci-après quelques exemples : argon, di-azote, solides, limite à basse densité (≈ gaz)
Argon
Pour un système réel, quelques écarts par rapport à la régularité des pics peut être observé :
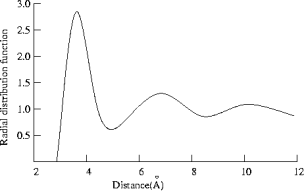
Image provenant d'une simulation moléculaire dynamique de l'argon à 100K, on remarque
Ar = liquide homogène et monoatomique → position des pics espacée de façon quasi régulière : pic à 3,7 Å, puis vers 6,9 Å puis vers 10,2 Å. → à rapprocher du rayon de van der Waals de l'atome d'argon : 1,88 Å, soit un diamètre de 3,76 Å.
l'espacement n'est pas régulier mais c'est parce qu'il correspond à une simulation en situation "réelle", ie. température de 100 K. les molécules ne sont alors pas parfaitement ordonnées dans le système et de petits espaces entre les molécules existent.
Molécule d'azote N2
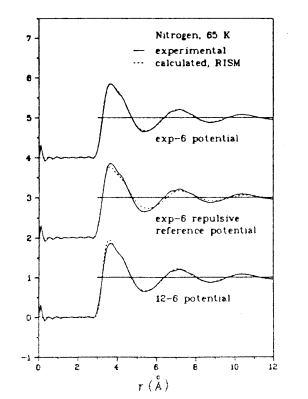
On note l'accord excellent pour tous les potentiels, notamment pour le potentiel de Buckingham. Il valide ces modèles pour décrire le comportement et calculer les propriétés thermodynamiques de la molécule d'azote à cette température.
Molécule polyatomique : eau liquide
Calcul de g(r) pour les trois paires d'atomes dans la glace à 220 K : H-H, O-O, O-H.
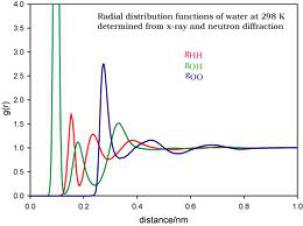
pic vert (paire O-H) très grand autour de 0,07-0,09 nm, en parfait accord avec la longueur moyenne des liaisons O-H, 0.074 nm.
premier pic rouge (paire H-H) = distance moyenne entre H1 et H2 dans une même molécule d'eau.
premier pic bleu = distance moyenne entre deux atomes d'oxygènes les plus proches.
Ensembles ces pics permettent donc d'interpréter de façon très détailler une structure tridimensionnelle de l'eau.
Solides
La figure compare g(r) pour l'argon en phase liquide et solide :
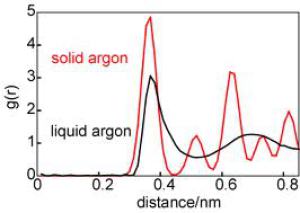
La position de pics dépend du compactage du solide, qui varie selon la structure du solide : solide amorphe, solide cristallin.
Pour un solide cristallin le compactage varie selon le type de réseau cristallin ; les réseaux hexagonal compact et cubique à faces centrées ont la compacité la plus élevée. Elle vaut 74 %.
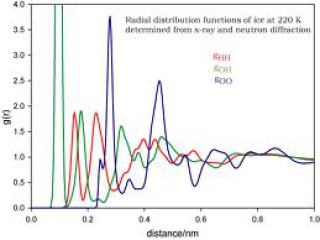
La figure calcule g(r) pour les trois paires d'atomes dans la glace à 220 K : H-H, O-O, O-H. Par rapport à l'eau liquide, il y a beaucoup plus de pics = plus grande structuration de la glace, un solide, par rapport à l'eau, un liquide.
Limite à haute température
Définition : Fonction de distribution radiale à haute température
à haute température, le facteur β=1/kBT tends vers zéro, dans l'expression de g(r) l'exponentielle tends vers 1 et la fonction de distribution radiale à haute température s'exprime de la façon suivante :
![]()
qui tends vers 1 lorsque le nombre de particule est très grand
limite à basse densité : Gaz
Définition : Fonction de distribution radiale à basse densité
La fonction de distribution radiale à basse densité s'exprime de la façon suivante :
![]()
On note que le terme de droite est le facteur de Boltzmann.
La figure ci-dessous compare g(r) pour l'argon liquide et gaz à deux températures, issus de calculs théoriques.
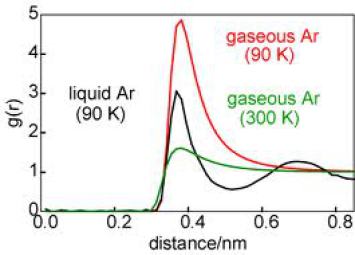
On constate que :
le gaz ne présente plus de structure et n'a qu'un seul pic, caractéristique de ses plus proches voisins. Au delà, les molécules de gaz sont trop éloignées pour être corrélées avec la molécule centrale.
Dit autrement, La molécule centrale n'a d'interaction significative qu'avec ses plus proches voisines. au delà, elle ne 'sent' que des interactions de plus en plus diffuses, expliquant la décroissance.
Par ailleurs, lorsque la température augmente, la limite tends vers 1-1/N et effectivement le pic s'aplatit.
Remarque : g(r) d'un gaz parfait
De l'observation ci-dessus et en application de l'hypothèse gaz parfait VN=0, on obtient naturellement que g(r)gaz parfait=1
cela signifie que pour une molécule centrale, on ne peut trouver autre molécule corrélée. Dit autrement, n'ayant pas d'interaction avec aucune autre molécule, elle ne 'sent' aucune d'entre elles.





