Equations d'état de van der Waals généralisée : répulsion + attraction
Remarque : RT ou kBT ?
Dans tout ce cours, nous travaillons avec comme élément de référence une particule, expliquant pourquoi nos équations font intervenir le terme kBT. Par exemple l'équation d'état de van der Waals :
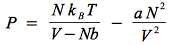
où V est le volume total
En thermodynamique classique, il est de coutume de prendre comme référence une mole de matière, et donc d'écrire les équations avec le terme R T où R est la constante des gaz parfait et est le produit du nombre d'avogadro NA= 6,02214129(27) × 1023 mol-1 et de kB=1,3806488 × 10-23 J.K-1 : R = NA kB= 8,3144621 J.K-1.mol-1.
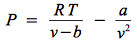
où v est le volume molaire.
Les équations cubiques exprimées en facteur de compressibilité Z=PV/RT s'écrivent sous la forme d'une somme de contribution répulsive et attractive (aussi appelée dispersion).
Le terme répulsif de van der Waals provient d'un potentiel de sphères dures (équations classiques vdW, RK, SRK, PR) ou en fonction de corps convexes "durs" dépendant de la compacité ζ3 qui dépend de la densité ρ (ou volume molaire v) et de la taille de la molécule et d'un paramètre de forme α (rapport de grandeurs décrivant la géométrie du corps convexe).






